Основное про сертификацию
С 01.07.2017 ввод в обращение импортных или произведенных в Украине медицинских изделий, их продажа и применение разрешены только при соответствии требованиям Технических регламентов. Это означает, что медицинские изделия на момент ввоза (импорта), продажи, введения в эксплуатацию или применения должны иметь:
- Декларацию о соответствии;
- Сертификат соответствия и/или внесение в реестр ГосЛекСлужбы;
- Маркировку упаковки/этикетки знаком соответствия, соответствующую национальным требованиям и предоставленную на украинском языке;
- Инструкцию по применению на украинском языке, если такая предусмотрена производителем;
- Техническую документацию, демонстрирующую соответствие Основным требованиям.
Для оформления данных документов нужно провести процедуру, предусмотренную Техническим регламентом. Существует несколько процедур установки соответствия в зависимости от потенциального риска применения медицинского изделия. Наиболее безопасные медицинские изделия проходят упрощенную процедуру, и чем выше риск — тем выше требования и сложнее процедура сертификации.
Согласно статьи 193 Налогового кодекса Украины, все медицинские изделия, соответствующие требованиям технических регламентов, облагаются ставкой в 7% НДС при ввозе и обращении. На период карантина, вызванного коронавирусной болезнью, введены исключения на порядок ввоза и налогообложения некоторых медицинских изделий.
|
С 2007 года мы профессионально выполняем консалтинговые работы по оценке соответствия (сертификации, регистрации) медицинских изделий в Украине. Мы провели сертификацию самых различных медицинских изделий и медицинской техники более 900 зарубежных и национальных производителей. Наши специалисты отлично владеют законодательством, ведут переписку на английском языке, имеют большой опыт и смогут ответить на все вопросы. Начав сотрудничество с нами — Вы получите качественный, профессиональный и быстрый результат. |
C чего начать оценку соответствия (сертификацию, регистрацию) медицинских изделий?
Исходя из характеристик медицинского изделия нужно определить применимые сертификационные процедуры и выбрать наиболее выгодную. Существует несколько основных процедур оценки соответствия:
- Самодекларирование и регистрация в ГосЛекСлужбе;
- Оценка соответствия путем аудита производства;
- Ускоренная и упрощенная процедура с частичным признанием ЕС сертификата;
- Сертификация партии.
Процедура определяется классом медицинского изделия и другими его характеристиками (например, стерильностью, наличием измерительных функций, содержанием лекарственных средств в составе и пр.). Достаточно часто из нескольких процедур можно выбрать наиболее удобную и экономически выгодную.
Правильно выбранная процедура может сэкономить много времени и средств, поэтому в самом начале важно проанализировать все возможные варианты. Для этого нужно изучить список продукции и получить некоторые исходные документы.
Оценку соответствия медицинских изделий высоких классов проводят 11 назначенных органов, и для принятия верного решения нужно отлично ориентироваться в их возможностях, требованиях и ценах. Каждая организация имеет свою специализацию, экспертов с различными знаниями и подготовкой, техническую базу, разный подход к срокам и стоимости работ. То, что в одном органе можно сделать быстро и дешево — в другом может оказаться трудной и дорогой задачей.
| Мы отлично владеем всеми процедурами сертификации и сотрудничаем с большинством органов по оценке соответствия. Мы заранее объясним плюсы и минусы, рассчитаем расходы как на первичную процедуру, так и на ежегодное поддержание (если такие могут возникнуть), расскажем обо всех возможных подводных камнях и поможем их избежать. |
Кто такой Уполномоченный представитель производителя?
Одним из первых шагов в сертификации является назначение Уполномоченного представителя производителя в Украине. Уполномоченный представитель — компания-резидент, включая Представительство иностранной компании, или ФЛП, которого зарубежный производитель письменно авторизировал на выполнение необходимых законодательных требований и решения различных вопросов в Украине.
Название и адрес Уполномоченного представителя размещаются на маркировке каждого медицинского изделия и/или в инструкции по применению, а также указываются в Декларации соответствия и сертификате соответствия. Уполномоченный представитель не обязательно должен быть импортером, а может авторизовать другие компании на ввоз и дистрибуцию.
Уполномоченный представитель выполняет роль связующего между Украиной (органами по оценке соответствия, органом рыночного надзора, органами доходов и сборов, потребителями и пр.) и зарубежным производителем:
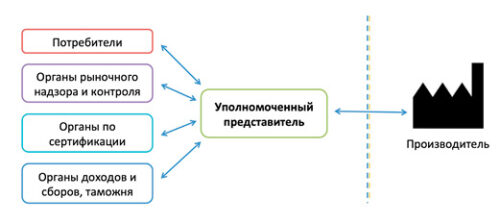
Также у Уполномоченного представителя есть множество других обязательств: хранить техническую документацию не менее 5 лет, участвовать в проверках органов рыночного надзора и оплачивать штрафы за производителя, выполнять пост-маркетинг и уведомлять об инцидентах, блокировать серый импорт и пр.
Каждое медицинское изделие (тип/модель) должно быть связано только с одним Уполномоченным представителем. Производитель может назначить нескольких Уполномоченных представителей, но для разных медицинских изделий.
Подробно о функциях, правах и обязанностях Уполномоченного представителя читайте по ссылке.
| Наш юрист подготовит проект Доверенности и/или Договора на назначение Уполномоченного представителя в Украине, ответит на вопросы производителя, пояснит требования к легализации и сопроводит подписание. Мы постоянно следим за обновлениями и вовремя реагируем на основные замечания со стороны таможни, органов рыночного надзора и органов по оценке соответствия — будьте уверены, что вся юридическая документация, которая используется в работе, отвечает последним требованиям законодательства и компетентных органов. |
Документация для оценки соответствия медицинских изделий
Требуется собрать, подготовить и упорядочить комплект документов, демонстрирующих соответствие Основным требованиям и позволяющих в течении законодательно установленного срока проверить соответствие. Комплект документов должен включать оригинальные технические документы Производителя и украинские национальные документы и формы, решения национальных органов по оценке соответствия (если применимо). Документация должна храниться Уполномоченным представителем или производителем в течение 5 лет (15 лет для активных имплантируемых медицинских изделий) с момента размещения на рынке последнего медицинского изделия для предоставления по запросу компетентных органов.
Список документов зависит от сертификационной процедуры и требований назначенного органа. Часть документации потребуется переводить на украинский язык, обязательно переводится инструкция по применению (руководство пользователя).
На основании документации производителя разрабатываются следующие национальные документы:
- Заявка на оценку соответствия и/или уведомление для регистрации медицинского изделия;
- Инструкция по применению (если предусмотрена);
- Проект упаковки, этикетки;
- Чек-лист Основных требований, демонстрирующий соответствие;
- Декларация о соответствии;
- Сопроводительные письма и пр.
Национальные документы разрабатываются на украинском языке, а некоторые — двуязычными для лучшего понимания производителем и упрощения таможенного оформления.
Технические регламенты и другие законодательные акты устанавлив
ают требования к формам и содержанию документов,

Знак соответствия техническим регламентам
особые национальные символы и многое другое. По ссылке Вы можете прочитать более подробно о требованиях к маркировке упаковки и инструкции по применению (руководстве пользователя) для медицинских изделий в Украине.
На основании подготовленной документации проводится оценка соответствия, а информация будет перенесена в сертификат соответствия, Декларацию соответствия, реестр компетентного органа.
Корректно подготовленная документация и правильно проведенная процедура оценки соответствия помогает избежать проблем при таможенном оформлении, сохранить преференцию по НДС, соответствовать техническим заданиям тендеров, избежать штрафов и запретов от органов рыночного надзора.
Документация должна храниться Уполномоченным представителем или производителем в течение 5 лет (15 лет для активных имплантируемых медицинских изделий) с момента размещения на рынке последнего медицинского изделия для предоставления по запросу компетентных органов. В течении данного периода документацию имеет право проверить органы рыночного надзора — Государственная служба Украины лекарственных средств и контроля за наркотиками, Государственная служба Украины по вопросам безопасности пищевых продуктов и защиты потребителей.
| Наша команда отлично владеет английским языком, профессиональной терминологией, требованиями национального и международного законодательства. Проверка соответствия требованиям украинского законодательства, заполнение национальных документов и форм является частью наших работ по оценке соответствия медицинских изделий. |
Упрощенная / ускоренная процедура сертификации медицинских изделий
Аудит (инспектирование) производства является наиболее частой процедурой, а также — наиболее длительной и затратной. Аудит является обязательным для всех стерильных медицинских изделий, всех активных имплантируемых медицинских изделий и наиболее часто применим для изделий III-го (максимального) класса потенциального риска, изделий списка “А” для диагностики in-vitro.
Сертификат соответствия путем аудита выдается сроком на 5 лет, однако каждые 12 месяцев требуется проходить плановый надзор путем сокращенного инспектирования производства. Надзор — существенная ежегодная статья расходов на поддержание сертификации.
В феврале 2016 года был принят Закон Украины “Про технические регламенты и оценку соответствия”, который позволил проводить упрощенную и ускоренную процедуру для медицинских изделий, одобренных на рынке Европейского союза.
Данная процедура не является обменом ЕС сертификата на украинский сертификат. Для ее выполнения необходимо выполнить все национальные требования, в том числе назначить Уполномоченного представителя, собрать и оформить документацию, выполнить требования по языку и маркировке, и пройти предусмотренные выбранной процедурой оценки соответствия этапы.
Однако данная процедура позволяет заменить аудит украинского сертификационного органа экспертизой протоколов европейских нотификационных органов.
Признание протоколов европейский нотификационных органов позволяет избежать всех аудитов, связанных с оценкой соответствия медицинского изделия в Украине — инициального, ежегодных надзорных, ресертификационного.
Более подробно о процедуре признания ЕС сертификатов в Украине и списке европейских органов, сертификаты которых признаются в Украине.
 |
Читайте нашу статью “Признание сертификатов ЕС на медицинские изделия в Украине” (октябрь 2019 года). |
| Мы провели более 500 процедур сертификации упрощенным путем признания, отлично владеем украинским и международным законодательством. Мы сможем профессионально и качественно провести ускоренную и упрощенную процедуру оценки соответствия медицинского изделия. |
Регистрация медицинских изделий
Внесение в реестр ГосЛекСлужбы является обязательным требованием для медицинских изделий I-го класса (включая Is, Im), всех изделий для диагностики in-vitro и изделий, изготовленных на заказ. Для данных медицинских изделий внесение в Реестр должно быть выполнено до размещения медицинского изделия на рынке (до таможенного оформления).
Регистрация выполняется согласно Приказа МОЗ Украины №122 от 10.02.2017, основанием для внесения в Реестр является поданный в ГосЛекСлужбу пакет документов. Реестр ведется в общедоступном электронном виде на сайте ГосЛекСлужбы.
Отказ от внесения в Реестр и исключение из реестра происходит в результате подачи неполных или недостоверных данных, отсутствия или окончания срока полномочий представителя, несоответствия медицинских изделий установленным требованиям, окончание срока Декларации соответствия и/или сертификата соответствия.
Поддержание сертификации
Технические регламенты устанавливают требования, которые должны выполняться на протяжении действия Декларации соответствия и/или сертификата соответствия, а также в течении 5 лет после (15 лет для активных имплантируемых изделий).
Контроль за выполнением пост-маркетинговых требований выполняют органы государственного рыночного надзора, назначенные органы по оценке соответствия. Невыполнение требований может привести к высоким штрафам (минимальный штраф для Уполномоченного представителя составляет 51 000 грн.), отмене преференции по НДС или ограничению обращения изделий, остановке или аннулирования сертификата и/или исключения из реестра.
Для начала сотрудничества или получения консультации Вы можете связаться с нами:
- по телефонам +38 044 361-48-28, +38 044 221-71-29,
- по e-mail info@cratia.ua,
- или приехать на встречу к нам в офис.

