Основне для сертифікації
З 01.07.2017 введення в обіг імпортних або вироблених в Україні медичних виробів, їх продаж і застосування дозволені тільки у разі відповідності вимогам Технічних регламентів. Це означає, що медичні вироби на момент ввезення (імпорту), продажу, введення в експлуатацію або застосування повинні мати:
- Декларацію про відповідність.
- Сертифікат відповідності та/або внесення до реєстру Держлікслужби.
- Маркування упаковки/етикетки знаком відповідності, що відповідає національним вимогам та українською мовою.
- Інструкцію із застосування українською мовою, якщо така передбачена виробником.
- Технічну документацію, яка демонструє відповідність Основним вимогам.
Для оформлення даних документів потрібно провести процедуру, передбачену Технічним регламентом. Існує кілька процедур встановлення відповідності залежно від потенційного ризику застосування медичного виробу. Найбільш безпечні медичні вироби проходять спрощену процедуру, і чим вище ризик, тим вище вимоги та складніша процедура сертифікації.
Згідно зі статтею 193 Податкового кодексу України, всі медичні вироби, які відповідають вимогам технічних регламентів, обкладаються ставкою в 7% ПДВ при їх ввезенні та введенні в обіг. На період карантину, викликаного коронавірусною хворобою, запроваджені виключення на порядок ввезення та оподаткування деяких медичних виробів.
|
З 2007 року ми професійно виконуємо консалтингові роботи з оцінки відповідності (сертифікації, реєстрації) медичних виробів в Україні. Ми провели сертифікацію самих різних медичних виробів та медичної техніки більше 900 закордонних і національних виробників. Наші фахівці відмінно володіють законодавством, ведуть листування англійською мовою, мають великий досвід і зможуть відповісти на всі запитання. Почавши співпрацю з нами, Ви отримаєте якісний, професійний і швидкий результат. |
З чого почати оцінку відповідності (сертифікацію, реєстрацію) медичних виробів?
Виходячи з характеристик медичного виробу, потрібно визначити застосовні сертифікаційні процедури і вибрати найбільш вигідну. Існує декілька основних процедур оцінки відповідності:
- Самодекларування та реєстрація в Держлікслужбі;
- Оцінка відповідності шляхом аудиту виробництва;
- Прискорена і спрощена процедура з частковим визнанням ЄС сертифіката;
- Сертифікація партії.
Процедура визначається класом медичного виробу та іншими його характеристиками (наприклад, стерильністю, наявністю вимірювальних функцій, вмістом лікарських засобів в складі тощо). Досить часто з кількох процедур можна вибрати найбільш зручну та економічно вигідну.
Правильно обрана процедура може заощадити багато часу і коштів, тому на самому початку важливо проаналізувати всі можливі варіанти. Для цього потрібно вивчити список продукції і отримати деякі вихідні документи.
Оцінку відповідності медичних виробів проводять 11 призначених органів, і для прийняття вірного рішення необхідно добре орієнтуватися в їх можливостях, вимогах і цінах. Кожна організація має свою спеціалізацію, експертів з різними знаннями і підготовкою, технічну базу, різний підхід до строків і вартості виконання робіт. Те, що в одному органі можна зробити швидко і дешево, в іншому може виявитися важким і дорогим завданням.
| Ми відмінно володіємо усіма процедурами сертифікації та співпрацюємо з більшістю органів з оцінки відповідності. Ми заздалегідь пояснимо плюси і мінуси, розрахуємо витрати як на первинну процедуру, так і на щорічне підтримання (якщо такі можуть виникнути), розповімо про всі можливі підводні камені та допоможемо їх уникнути. |
Хто такий Уповноважений представник виробника?
Одним з перших кроків процесу сертифікації є призначення Уповноваженого представника виробника в Україні. Уповноважений представник – компанія-резидент, включаючи Представництво іноземної компанії, або ФОП, яку закордонний виробник письмово авторизував на виконання необхідних законодавчих вимог та вирішення різних питань в Україні.
Назва та адреса Уповноваженого представника розміщуються на маркуванні кожного медичного виробу та/або в інструкції із застосування, а також вказуються в Декларації відповідності і сертифікаті відповідності. Уповноважений представник не обов’язково повинен бути імпортером, а може авторизувати інші компанії на ввезення і дистрибуцію.
Уповноважений представник виконує роль сполучної ланки між Україною (органами з оцінки відповідності, органом ринкового нагляду, органами доходів і зборів, споживачами тощо) і закордонним виробником:
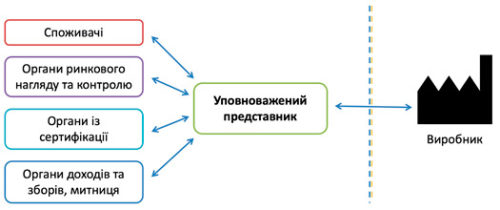
Також у Уповноваженого представника є безліч інших зобов’язань: зберігати технічну документацію не менше 5 років, брати участь у перевірках органів ринкового нагляду та оплачувати штрафи за виробника, виконувати пост-маркетингове спостереження та повідомляти про інциденти, блокувати сірий імпорт тощо.
Кожен медичний виріб (тип/модель) має бути пов’язаний лише з одним Уповноваженим представником. Виробник може призначити декількох Уповноважених представників, але для різних медичних виробів.
Докладно про функції, права та обов’язки Уповноваженого представника читайте за посиланням.
| Наш юрист підготує проект Довіреності та/або Договору на призначення Уповноваженого представника в Україні, відповість на запитання виробника, пояснить вимоги до легалізації і супроводить підписання. Ми постійно стежимо за оновленнями і вчасно реагуємо на основні зауваження з боку митниці, органів ринкового нагляду та органів з оцінки відповідності, тому будьте впевнені, що вся юридична документація, яка використовується в роботі, відповідає останнім вимогам законодавства і третіх сторін. Ми також допоможемо налаштувати роботу Уповноваженого представника. |
Документація для оцінки відповідності медичних виробів
Для проведення оцінки відповідності потрібно зібрати, підготувати і оформити пакет документації, який буде включати вихідні технічні документи виробника та національні форми і документи. Список документів залежить від сертифікаційної процедури і вимог призначеного органу.
Частину документів потрібно перекладати українською мовою, обов’язково перекладається інструкція із застосування (керівництво користувача).
На підставі документації виробника розробляються наступні національні документи:
- Заявка на оцінку відповідності та/або повідомлення для реєстрації медичного виробу;
- Інструкція із застосування (якщо передбачена);
- Проект упаковки, етикетки;
- Чек-лист Основних вимог, що демонструє відповідність;
- Декларація про відповідність;
- Супровідні листи тощо.
Національні документи розробляються українською мовою, а деякі є двомовними для кращого розуміння виробником і спрощення митного оформлення.
Технічні регламенти та інші законодавчі акти встановлюють вимоги

Знак відповідності технічним регламентам
до форм і змісту документів, особливі національні символи і багато іншого. За посиланням Ви можете прочитати більш докладно про вимоги до маркування упаковки та інструкції із застосування (керівництва користувача) для медичних виробів в Україні.
На підставі даної документації буде проведена оцінка відповідності, а інформація буде перенесена в сертифікат, Декларацію, Реєстр. Невірно підготовлені документи можуть призвести до проблем при митному оформленні та втрати преференції з ПДВ, до відмов у тендерах, до штрафів від органів ринкового нагляду, заборони на обіг та інших неприємностей.
Також дана документація повинна зберігатися Уповноваженим представником виробника протягом щонайменше 5 років після введення в обіг медичних виробів. Документацію має право перевірити орган ринкового нагляду за медичними виробами – Держлікслужба України.
| Наша команда відмінно володіє англійською мовою і термінологією, ми готові вести переписку з виробником безпосередньо або через Вас. Ми запитаємо і перевіримо документи, проведемо переписку стосовно відсутніх частин, самостійно виконаємо переклади, підготуємо та оформимо всі національні форми. |
Спрощена/прискорена процедура сертифікації медичних виробів
Аудит (інспектування) виробництва є найчастішою процедурою, а також найбільш тривалою та витратною. Аудит є обов’язковим для всіх стерильних медичних виробів, всіх активних медичних виробів, які імплантують, і найчастіше застосовується для виробів III-го (максимального) класу потенційного ризику, виробів списку «А» для діагностики in-vitro.
Сертифікат відповідності після аудиту видається строком на 5 років, однак кожні 12 місяців потрібно проходити плановий нагляд шляхом скороченого інспектування виробництва. Нагляд – істотна щорічна стаття витрат на підтримання сертифікації.
У лютому 2016 року було прийнято Закон України «Про технічні регламенти та оцінку відповідності», який дозволив проводити спрощену і прискорену процедуру для медичних виробів, схвалених на ринку Європейського союзу.
Ця процедура не є обміном ЄС сертифіката на український сертифікат. Для її виконання необхідно виконати всі національні вимоги, в тому числі призначити Уповноваженого представника, зібрати і оформити документацію, виконати всі вимоги стосовно мови та маркування, але це дозволяє уникнути аудиту виробника шляхом експертизи протоколів європейських органів.
Більш докладно про процедуру визнання ЄС сертифікатів в Україні та списку європейських органів, сертифікати яких визнаються в Україні.
 |
Читайте нашу статтю «Визнання сертифікатів ЄС на медичні вироби в Україні» (жовтень 2019 року). |
| Ми провели більше 500 процедур сертифікації спрощеним шляхом визнання, відмінно володіємо українським та міжнародним законодавством, готові швидко і якісно провести процедуру оцінки відповідності без аудиту. |
Реєстрація медичних виробів
Внесення до реєстру Держлікслужби є обов’язковою вимогою для медичних виробів I-го класу (включаючи Is, Im), всіх виробів для діагностики in-vitro та виробів, виготовлених на замовлення. Для даних медичних виробів внесення до Реєстру повинно бути виконано до розміщення медичного виробу на ринку (до митного оформлення).
Реєстрація виконується згідно з Наказом МОЗ України № 122 від 10.02.2017, підставою для внесення до Реєстру є поданий до Держлікслужби пакет документів. Реєстр ведеться в загальнодоступному електронному вигляді на сайті Держлікслужби.
Відмова від внесення до Реєстру та виключення з реєстру відбувається в результаті подачі неповних або недостовірних даних, відсутності або закінчення терміну повноважень представника, невідповідності медичних виробів встановленим вимогам, закінчення терміну Декларації відповідності та/або сертифіката відповідності.
Підтримка сертифікації
Технічні регламенти встановлюють вимоги, які повинні виконуватися протягом терміну дії Декларації відповідності та/або сертифіката відповідності, а також протягом 5 років після (15 років для активних виробів, які імплантують).
Контроль за виконанням пост-маркетингових вимог виконують органи державного ринкового нагляду, призначені органи з оцінки відповідності. Невиконання вимог може привести до високих штрафів (мінімальний штраф для Уповноваженого представника становить 51 000 грн.), скасування преференції з ПДВ або обмеження обігу виробів, до зупинки або анулювання сертифіката та/або виключення з реєстру.
Для початку співпраці або отримання консультації Ви можете зв’язатися з нами:
- за телефонами +38 044 361-48-28, +38 044 221-71-29,
- по e-mail: info@cratia.ua,
- або приїхати на зустріч до нас в офіс .

