Уповноважений представник
Виробник-нерезидент повинен призначити уповноваженого представника в Україні, яким може бути юридична особа або ФОП (фізична особа-підприємець), резидент України.
Уповноважений представник в Україні є сполучною ланкою між Україною (органами з оцінки відповідності, органом ринкового нагляду, органами доходів і зборів, споживачами тощо) та виробником, забезпечує своєчасний обмін інформацією, виконує постмаркетинговий нагляд.
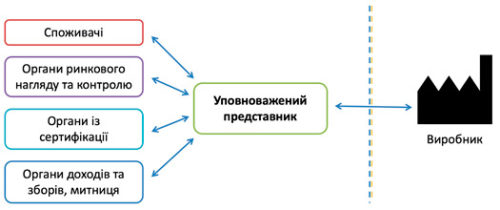
Уповноважений представник в Україні
Також у Уповноваженого представника є безліч інших прав і зобов’язань: зберігати технічну документацію не менше 5 років (15 років для активних виробів, які імплантують) з моменту випуску останнього виробу, брати участь у перевірках органів ринкового нагляду та оплачувати штрафи за виробника, виконувати постмаркетингове спостереження та повідомляти про інциденти, авторизувати імпортерів, блокувати сірий імпорт тощо.
Кожний медичний виріб (тип/модель) має бути пов’язаний лише з одним Уповноваженим представником. Виробник може призначити декількох Уповноважених представників, але для різних медичних виробів.
Назва та місцезнаходження уповноваженого представника повинні бути нанесені на упаковку кожного медичного виробу та/або в інструкції по застосуванню. Для поліпшення зв’язку зі споживачем ми також рекомендуємо вказувати номер телефону, е-мейл та веб-сайт. Назва і адреса уповноваженого представника також будуть вказані в декларації і сертифікаті відповідності.
Уповноваженим представником може виступити імпортер, дистриб’ютор або третя організація. Деякі виробники мають внутрішнє правило, згідно з яким уповноваженим представником не може бути організація, яка бере участь в ланцюзі постачання продукції. Також, якщо виробник працює з декількома дистриб’юторами, призначення одного з них уповноваженим представником надасть істотну конкурентну перевагу, так як його назва та адреса будуть на маркуванні всіх виробів, що постачаються в Україну.
Договір та Довіреність
Призначення уповноваженого представника виконується в письмовому вигляді Довіреністю і/або Договором. Довіреність повинна бути належним чином завірена та легалізована.
Ми рекомендуємо використовувати обидва документи:
Довіреність має менший обсяг, її зручно використовувати для подачі в зовнішні організації, однак Довіреність передає права тільки в односторонньому порядку.
Договір може врегулювати права та обов’язки обох сторін, обмежити відповідальність уповноваженого представника щодо якості та безпеки медичних виробів, встановити строки комунікації, порядок взаємодії з рекламаціями і повідомленнями про небажані явища, щодо багатьох інших аспектів.
Договір призначення уповноваженого представника не рівнозначний договору на імпорт/дистрибуцію і зазвичай є окремим документом, який за своєю структурою більш нагадує операційну процедуру. У деяких випадках Договір призначення уповноваженого представника може бути додатком до Договору на імпорт та дистрибуцію.
Наш юрист підготує проект Довіреності та/або Договору на призначення Уповноваженого представника в Україні, відповість на питання виробника, пояснить вимоги до легалізації та супроводить підписання. Ми постійно стежимо за оновленнями і вчасно реагуємо на основні зауваження з боку митниці, органів ринкового нагляду та органів з оцінки відповідності, тому будьте впевнені, що вся юридична документація, яка використовується в роботі, відповідає останнім вимогам законодавства та третіх сторін.
Реєстрація уповноваженого представника
У деяких випадках дані про особу, відповідальну за введення в обіг медичних виробів, підлягають реєстрації в компетентному органі – Державній службі України з лікарських засобів і контролю за наркотиками (Держлікслужба).
Реєстрація проводиться до введення в обіг:
- медичних виробів I-го класу, в тому числі стерильних і/або з функцією вимірювання;
- процедурних наборів;
- всіх медичних виробів для діагностики in-vitro.
Порядок реєстрації описаний в Технічних регламентах і Наказі МОЗ України № 122 від 10.02.2017 року. Реєстр публікується в електронному вигляді на веб-сайті Держлікслужби.
Обов’язки і відповідальність
Обов’язки Уповноваженого представника описані як в Технічних регламентах для медичних виробів, так і в суміжних законодавчих актах. Перелік основних обов’язків:
- Нести відповідальність за медичні вироби, введені в обіг.
- Взаємодіяти з органами ринкового нагляду, правоохоронними та іншими компетентними органами від імені виробника.
- Зберігати документацію не менше 5 років (15 років для активних виробів, які імплантують) з моменту випуску останнього виробу на ринок і надавати в компетентні органи.
- Виконувати постмаркетингове спостереження:
- збирати дані про інциденти на ринку України та повідомляти виробника,
- подавати до компетентного органу дані про всі серйозні інциденти в Україні та в світі, які могли або призвели до смерті користувача або істотного погіршення його здоров’я,
- технічні або медичні причини, які призводять до систематичного відкликання продукції.
- Виконувати коригувальні та обмежуючі дії щодо продукції.
- Інформувати компетентний орган про коригувальні дії та відкликання продукції.
- Оплачувати штрафи за введення в обіг невідповідної продукції.
Штрафи встановлені статтею 44 Закону України «Про державний ринковий нагляд і контроль нехарчової продукції»:
- Введення в обіг продукції, що становить серйозний ризик, – 102 000 грн.
- Введення в обіг продукції, яка не відповідає встановленим вимогам, – 51 000 грн.
- Невиконання або неповне виконання рішення про вжиття обмежувальних (коригувальних) заходів щодо продукції, що становить серйозний ризик, – 170 000 грн.
- Невиконання або неповне виконання рішення про вжиття обмежувальних (коригувальних) заходів щодо іншої продукції – 102 000 грн.
- Створення перешкод шляхом недопущення до проведення перевірок характеристик продукції – 170 000 грн.
Штрафи накладаються за кожну модель, артикул або партію продукції, яка є небезпечною, становить ризик та/або не відповідає встановленим вимогам, незалежно від кількості одиниць такої продукції та/або місць реалізації.
Аутсорсинг послуги Уповноваженого представника
Якщо виробник з яких-небудь причин не може призначити дистриб’ютора уповноваженим представником, або співпрацює з декількома дистриб’юторами, ми можемо взяти на себе цю роль. Компанія «Кратія Медтехніка» спеціалізується на виконанні функцій Уповноваженого представника, сертифікована за стандартом ISO 9001:2017, має штат компетентних фахівців.
Ми не залучені в товаропровідні процеси, що гарантує відсутність конфлікту інтересів та професійне виконання зобов’язань. Наша відповідальність перед третіми особами застрахована згідно Договору добровільного страхування професійної відповідальності.
Виділений веб-сайт: https://uarep.com/
Для початку співпраці або отримання консультації Ви можете зв’язатися з нами:
- за телефонами +38 044 361-48-28, +38 044 221-71-29,
- по e-mail: info@cratia.ua,
- або приїхати на зустріч до нас в офіс .

