Извините, этот текст доступен только на “Ukr” и “Eng”.
Продление переходных периодов и признание сертификатов MDR и IVDR в Украине
Компания «Кратия» приняла участие в 12-м Украинском форуме операторов рынка медицинских изделий, выступив спонсором мероприятия и поделился важной и актуальной информацией о оценке соответствия медицинских изделий в Украине. Темой доклада было «Продление признания сертификатов CE MDD до конца 2028 года. Признание сертификатов MDR и IVDR в Украине».
Виктория Мороз, специалист по ключевым клиентам, рассмотрела ряд важных вопросов касательно изменений в регуляторной среде, а именно: продление признания MDD ЕС сертификатов до 2028 года в связи с продлением переходных периодов в ЕС и признание MDR и IVDR сертификатов в Украине.
Продление признания CE MDD сертификатов до конца 2028 года
В первой части выступления Виктория подчеркнула, что признание сертификатов ЕС является прозрачным и распространенным способом оценки соответствия. Признание позволяет избежать аудита, который является стрессовым для производителя, так как требует соответствующей подготовки, организации и координации всего процесса.
Изменения в Европейском Союзе в текущем году затронули переходный период MDR из-за ряда обстоятельств, включая строгие требования MDR/IVDR и сжатые сроки их соблюдения, влияние пандемии COVID-19 на клинические исследования медицинских изделий, проведение удаленных аудитов и нарушения глобальных цепочек поставок медицинских изделий.
Ранее переходный период с MDD на MDR завершался 26 мая 2024 года. Соответственно, большинство ЕС сертификатов действовали до этой даты. Внесенные изменения Регламентом ЕС 2023/607 от 20 марта 2023 года продлили срок действия MDD ЕС сертификатов на новые сроки.
Новыми сроками переходных периодов являются:
- до 26 мая 2026 года для медицинских изделий класса III, имплантируемых, изготовленных по заказу;
- до 31 декабря 2027 года для медицинских изделий класса III и класса IIб, имплантируемых, за исключением шовных материалов, скоб, зубных пломб, зубных брекетов, зубных коронок, гвинтов, клиньев, пластин, проводов, шпилек, зажимов и соединителей;
- до 31 декабря 2028 года для остальных медицинских изделий класса IIб, класса IIa и I, вводимых в оборот в стерильном состоянии или имеющих измерительную функцию;
- до 31 декабря 2028 года для изделий, не требующих привлечения уведомленного органа согласно MDD, но требующих его привлечения согласно MDR (например, изделия I класса, такие как хирургические инструменты многоразового использования).
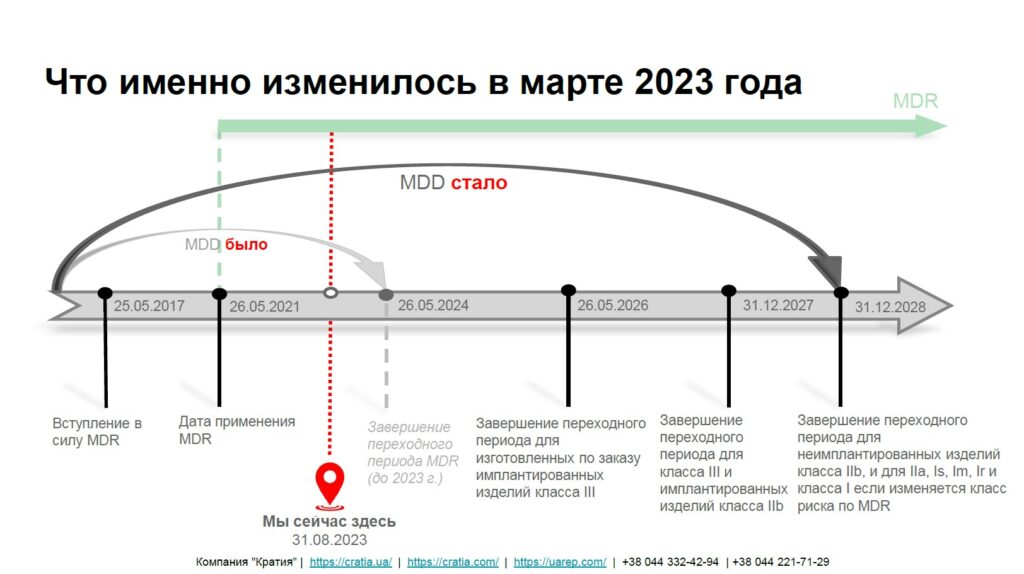
Изменения в переходных периодах в Европейском Союзе также позволяют продлить действие украинских сертификатов соответствия до 31 декабря 2028 года или ранее, в зависимости от классификации медицинских изделий. Кроме того, можно не только продлить текущие сертификаты соответствия в соответствии с Техническим регламентом 753, но и провести первичную сертификацию путем признания сертификата MDD с продленным сроком действия до 2027/2028 года.
Признание сертификатов MDR и IVDR в Украине
Во второй части выступления Виктория рассказывала о признании сертификатов MDR и IVDR, представила аргументацию в отношении законодательных оснований процедуры признания в Украине и поделилась практическими советами, после чего прошла активная дискуссия с аудиторией.
Требования новых Регламентов MDR и IVDR выше, чем требования предыдущих Директив MDD и IVDR. Следовательно, уровень требований MDR и IVDR выше, чем украинских технических регламентов для медицинских изделий.
В соответствии с пунктом 1 статьи 45 Закона Украины «О технических регламентах и оценке соответствия», возможно признание и принятие в Украине результатов оценки соответствия, проведенной в другой стране, если уровень соответствия требованиям такой же или выше. Следовательно, как вывод, признание сертификатов MDR и IVDR в Украине возможно и во многих аспектах считается наиболее целесообразным, — подчеркнула Виктория.
Ни одно из требований из старых Директив MDD или IVDD не было отменено в новых Регламентах MDR или IVDR. Фактически MDR и IVDR устанавливают дополнительные требования к соответствию, безопасности и контролю медицинских изделий.
В докладе были освещены важные особенности процедуры признания сертификатов MDR/IVDR. На практических примерах было рассмотрено, на что следует обратить внимание, какие вызовы ожидать, какие знания необходимо иметь и какие усилия нужно приложить для проведения признания MDR/IVDR сертификатов в Украине. В частности, требуется приложить много усилий для подготовки чек-листа соответствия установленным требованиям Приложения 1 Технического регламента 753. Это связано с тем, что положения нового ЕС чек-листа — General Safety and Performance Requirements (GPRS, ранее ERC), существенно отличаются от положений требований Приложения 1 Технического регламента 753. Как известно, чек-лист является одним из первых документов, который запрашивается органом рыночного надзора, например, во время проверок.
Также маркировка и инструкции по MDR/IVDR могут быть значительно более обширными, так как требования к этим документам также претерпели существенные изменения. Виктория напомнила, что маркировка и инструкции по применению медицинских изделий в Украине выполняются на государственном языке в соответствии с требованиями Закона Украины «Об обеспечении функционирования украинского языка как государственного» (пункт 6, статья 33).
Таким образом, признание сертификатов MDR и IVDR возможно. Этот путь оценки соответствия прозрачен, быстр и экономичен по сравнению с аудитом. Кроме того, процедура признания способствует сотрудничеству и обмену опытом между украинскими и европейскими органами. В частности, внедрение европейских практик в Украине является важным предпосылкой для подписания Соглашения об оценке соответствия и приемлемости промышленных товаров между Украиной и ЕС, то есть «промышленной безвизовой зоной» для медицинских изделий.

